Anche nel 2017 il contributo della Fondazione Dani Di Giò - Onlus supporta gli studi sui superbatteri.
In questi giorni è arrivato il resoconto sul lavoro svolto dal Dipartimento di Sanità Pubblica e Malattie Infettive da parte della dott.ssa Cecilia Ambrosi.
Dall’introduzione della pennicillina, gli antibiotici hanno considerevolmente contribuito alla salute dell’uomo nella cura delle infezioni batteriche. Tuttavia, la grande capacità adattiva batterica e l’eccessivo uso degli antibiotici hanno portato alla selezione di superbatteri, in grado di resistere a qualunque antibiotico.
Si prevede che nel 2050 le infezioni batteriche causeranno 10 milioni di vittime nel mondo, quindi più del cancro.
E’ emblematico il caso della resistenza ai carbapenemici.
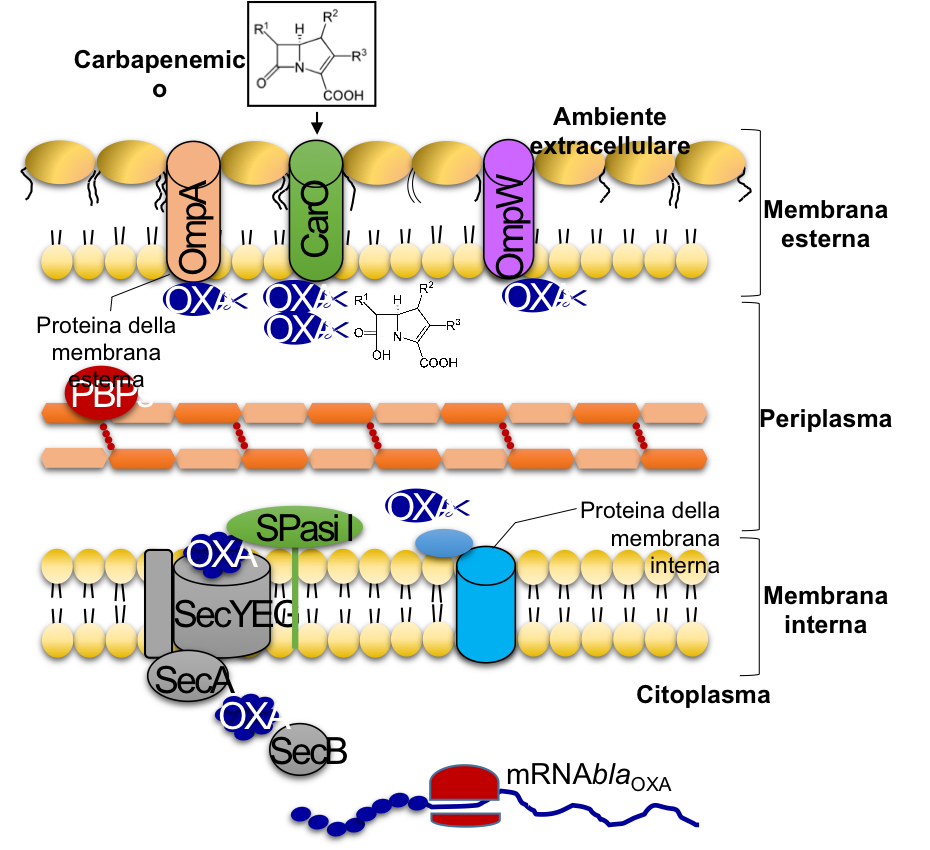
Questi antibiotici β-lattamici rappresentavano i farmaci di riferimento per la terapia delle infezioni invasive da batteri Gram-negativi multi-resistenti. I carbapenemici, come tutti gli antibiotici β-lattamici, agiscono impedendo l’azione degli enzimi responsabili della formazione dei legami crociati della parete cellulare dei batteri (penicillin binding proteins, PBPs); mancando tali legami, la parete batterica si indebolisce e i batteri muoiono. Il principale meccanismo di antibiotico-resistenza batterico ai β-lattamici è basato sull’espressione di enzimi denominati β-lattamasi in grado di rendere del tutto inefficace l’antibiotico.
Recentemente, Acinetobacter baumannii è stato messo nella lista dei superbatteri multi-resistenti dall’Organizzazione Mondiale della Sanità in quanto rappresenta una vera e propria minaccia per la salute umana. In A. baumannii, la resistenza ai carbapenemici è principalmente dovuta ad enzimi denominati oxacillinasi (OXA). I geni blaOXA vengono trascritti (mRNA) e tradotti all’interno del citoplasma della cellula batterica. Poi, queste pre-proteine, in una struttura non definitiva, vengono trasportate da un complesso proteico (SecYEG, SecB e SecA) dal citoplasma al periplasma. Subito dopo il trasporto, la peptidasi del segnale (SPaseI) converte le pre-proteine in proteine attive in grado di rendere del tutto inefficaci i carbapenemici.
Appare chiara ed urgente la necessità di studiare e sviluppare nuovi farmaci, preferibilmente con nuovi modi di azione per evitare nuovamente fenomeni di resistenza. Oltre allo sviluppo di nuovi antibiotici e peptidi antimicrobici, sono allo studio nuove classi di farmaci, come ad esempio molecole che contrastino l’attività di SecA e/o di Spasi I in modo da bloccare la secrezione e maturazione delle β-lattamasi e rendere nuovamente efficaci gli attuali antibiotici.
Ecco un resoconto grafico delle ultime ricerche: